La química trata con sustancias, y debido a que Delta S se usa en química, trata con el mismo asunto. Esto explica por qué Delta habla de cambios, reacciones y procesos. Hay otros tipos de Delta, como Delta Q y Delta T.
Sin embargo, este artículo se ocupará específicamente de Delta H y Delta S. El símbolo de Delta se parece un poco a un triángulo: ∆. Este símbolo representa “cambio” o “diferencia”.
También tienen otros nombres, como Delta H como entalpía y Delta S como entropía. Están relacionados entre sí porque se usan para describir variaciones.
Profundicemos más en la comprensión de estos términos.
¿Delta H es lo mismo que Delta S?
Delta H y Delta S son cosas completamente diferentes. Sin embargo, he descubierto que la gente a menudo confunde los dos términos. Es fácil mezclar sus significados y usarlos en otros contextos ya que suenan similares.
¡Aquí hay un consejo que te ayudará a recordar mejor los dos términos! Por favor, eche un vistazo a su ortografía respectiva. Como habrás notado, Delta H tiene «H» y hace entalpía.
Automáticamente, esto hace Delta S o entropía. Una forma más fácil de no olvidar esto es asociar y recordar la “H” presente en Delta H y la entalpía.
Como la entalpía contiene una H, se vuelve más fácil asociarla con Delta H. Así es como puede recordar los términos y diferenciarlos más fácilmente.
¿Qué es Delta H en Química?
Para comprender mejor a Delta S, veamos primero a Delta H. Se utiliza para describir si un sistema absorbe o emite calor. A diferencia de la entropía, la entalpía mide la energía total dentro de un sistema particular.
Por lo tanto, si el cambio en la entalpía o Delta H es positivo, eso indica un aumento en la cantidad total de energía dentro del sistema. Por otro lado, si Delta H o entalpía es negativa, esto se asocia con una disminución en la energía total contenida dentro de un sistema.
Fórmula para Delta H
La fórmula para la entalpía o Delta H es ∆H = mxsx ∆T. Para determinar el cambio de entalpía; debes hacer cálculos.
Debe calcular la masa total de los reactivos (m), el calor particular del producto (s) y Delta T, que es el cambio de temperatura de la reacción.
Simplemente reemplazando los valores en la fórmula, podemos multiplicar y resolver el cambio en la entalpía. En otras palabras, puedes encontrar Delta H en química restando la suma de las entalpías de los reactivos de las entalpías totales de los productos.
¿Qué significa si Delta H es positivo (+) o negativo (-)?
Como se mencionó anteriormente, un Delta H negativo está asociado con una disminución en la energía neta, y un Delta H positivo indica un aumento en la potencia total.
El hecho de que Delta H sea negativo sugiere que la reacción cede calor de los reactivos a los productos, lo que se considera favorable. Además, un Delta H negativo significa que el calor fluye de un sistema a su entorno.
Cuando Delta H es negativo, se considera como un Reacción exotérmica. Esto se debe a que la entalpía de los productos es menor que la de los reactivos en un sistema.
Las entalpías en una reacción son menores que cero y, por lo tanto, se consideran exotérmicas. Por el contrario, un Positivo Delta H indica el calor que fluye desde su entorno hacia un sistema. Esta es una reacción endotérmica donde se gana calor o energía.
Ejemplos de un Delta H positivo o negativo:
Un ejemplo para ayudar a comprender mejor las condiciones positivas o negativas de Delta H es: Cuando el agua cambia de líquido a sólido, Delta H se considera dañino ya que el agua emite calor a los alrededores.
Sin embargo, cuando el agua cambia de líquido a gas, Delta H se considera positivo ya que gana o absorbe calor de su entorno. Además, se suministran 36 kJ de energía a través de un calentador eléctrico sumergido en agua. En este caso, la entalpía del agua aumentará en 36 kJ y ∆H será igual a +36 kJ.
Este ejemplo confirma la idea de que Delta H es positivo cuando se obtiene energía del entorno en forma de calor.
¿Qué es Delta S?
Como se mencionó, delta s es un término que representa el cambio total en la entropía. Es una medida utilizada para determinar el grado de aleatoriedad o desorden en un sistema en particular.
¿Qué representa Delta S en química?
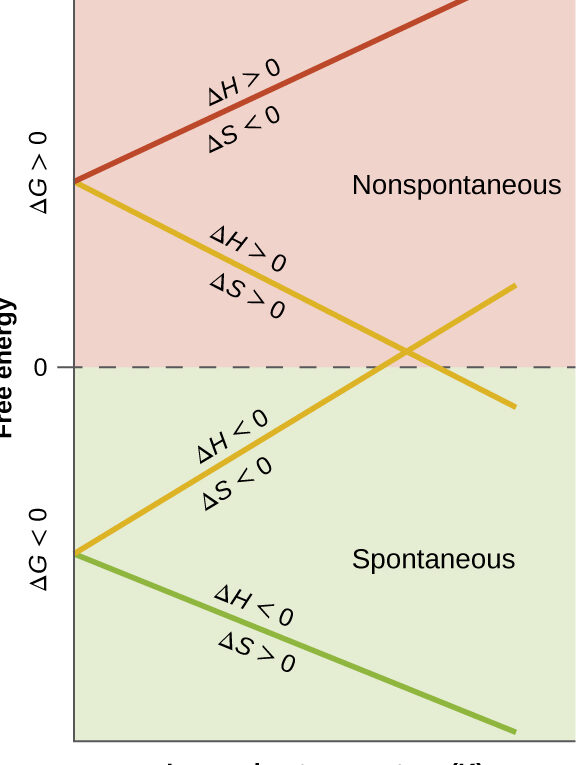
Delta S representa el cambio de entropía de reactivos a productos. Se mide de manera que la entropía del sistema aumenta después de que el valor de Delta S se vuelve positivo. A cambio positivo en la entropía se asocia con el aumento del trastorno.
Por lo tanto, todo cambio espontáneo ocurre debido al aumento de entropía del universo. Sin embargo, si la entropía de un sistema enfrenta una disminución después de un evento, entonces el valor de Delta S sería negativo.
Fórmula para Delta S
Él fórmula pues Delta S es el cambio de entropía igual a la transferencia de calor (Delta Q) dividido por la temperatura (T). La regla de «producto menos reactivos» se usa comúnmente para calcular Delta S para una reacción química.
Para mayor referencia o información, puede consultar Cambios de entropía en reacciones químicas para comprender mejor la fórmula y cómo se utiliza.
 Mantenga su fórmula en su mente para futuras referencias.
Mantenga su fórmula en su mente para futuras referencias.
¿Qué significa un Delta S positivo o negativo?
Como se indicó anteriormente, Delta S positivo está asociado con un proceso favorable. Es decir; la reacción continuará sin necesidad de aporte de energía.
Por otro lado, un Delta S negativo se asocia con un proceso desfavorable o no espontáneo. Esto sugiere que se requiere un aporte de energía para que un método continúe o una reacción.
Esta entrada de energía ayudará a que la reacción prosiga más, ya que un Delta S negativo no puede completar un proceso o responder de forma independiente, a diferencia del caso con Delta S positivo.
¿Predecir si Delta S es positivo (+) o negativo (-)?
Miremos a predecir la entropía de reacciones físicas y químicas! Para determinar si una reacción física o química aumentará o disminuirá la entropía, debe observar y examinar minuciosamente todas las fases de las especies presentes durante la respuesta.
Si ΔS es positivo, el desorden del universo es creciente. El cambio que denota un ΔS positivo generalmente se asocia con un aumento de reactivos a productos.
Un ejemplo de tal caso es: Si hay sólidos del lado de los reactivos y líquidos del lado de los productos, el signo de Delta S será positivo. Además, si hay sólidos en el lado de los reactivos e iones acuosos en el lado de los productos, esto también se asociará con una mayor entropía.
Por el contrario, un Delta S negativo está asociado con una inversión en las fases de reacción, y este cambio ahora es de líquidos a sólidos y de iones a sólidos. Esto conduce a una disminución de la entropía y, por tanto, a un Delta S negativo.
¡Echa un vistazo a este vídeo sobre la entropía para entender este concepto en química y física!
Aprenda del curso acelerado de Jeff Phillips sobre la entropía.
¿Cuál es la relación entre Delta S y Delta H?
en un sistema termodinámico, la entalpía (Delta H) es una propiedad de función de estado similar a la energía igual a la energía neta en un sistema. Al mismo tiempo, la entropía (Delta S) es el grado del desorden innato de un sistema bajo condiciones específicas.
Un científico holandés introdujo el término entalpía como «contenido de calor total». Su nombre es Heike Kamerlingh Onnes. De acuerdo con esto, la entalpía no solo tiene el contenido de calor total. También determina cuánto calor se agrega o elimina de un sistema.
Por otra parte, el término entropía se asocia con la idea de que el calor siempre fluye de las regiones calientes a las frías de forma espontánea, lo que se conoce como cambio de entropía. Esta vez, fue presentado por el científico Rudolf Clausius.
 Medir cosas no siempre es aburrido.
Medir cosas no siempre es aburrido.
uno crucial diferencia entre los dos es que sólo se puede medir el cambio de entalpía después de una reacción química. Delta H peralte se mide por sí mismo. Solo se puede medir la diferencia de energía o el cambio de calor.
Sin embargo, Delta S o entropía mide el movimiento en lugar del cambio total. En algunos casos, la entalpía es más significativa que la entropía después de la multiplicación de esta última por la temperatura T. En resumen, H > S. El exceso se conoce como energía libre de Gibbs.
¿Cuál es la diferencia entre Delta H y Delta S?
Es posible que ya haya aprendido las diferencias entre los dos. Pero en caso de que todavía te resulte difícil, aquí hay una tabla con un resumen diferencias entre entalpía y entropía:
Entalpía Entropía Medida de energía Medida de aleatoriedad o desorden Representado por Delta H Representado por Delta S Unidad: KiloJoules/mol Unidad: Joules/Kelvin.mole mídelo por sí mismoPuede medirseAplicable en condiciones estándarSin límites ni condicionesEl sistema favorece la entalpía mínimaEl sistema favorece la entropía máximaPuntos que podrían ayudarte a recordar.
Pensamientos finales
Si bien hay muchas diferencias entre los dos términos, hay algunas similitudes. Estos incluyen que tanto la entalpía como la entropía son funciones de estado y propiedades extensivas.
Para resumir, Delta H es un símbolo de entalpía, que mide cuánta energía tiene una partícula promedio en el sistema. Por otro lado, Delta S simboliza la entropía y una medida de desorden, caos y movimiento de las partículas dentro de un sistema.
Ambos términos son esenciales en el contexto de la comprensión de la forma en que se llevan a cabo los procesos o reacciones químicas. Si bien pueden ser diferentes, es a través de ambos que se pueden medir procesos químicos importantes.
Otros artículos de lectura obligada
Haga clic aquí para ver el resumen de este artículo en forma de historia web.